- 从赛场争议到医疗新前沿,伊布莫仑到底是什么?
一边是FDA的安全警示,一边是制药公司的临床研发,同一化合物的不同命运引人深思。
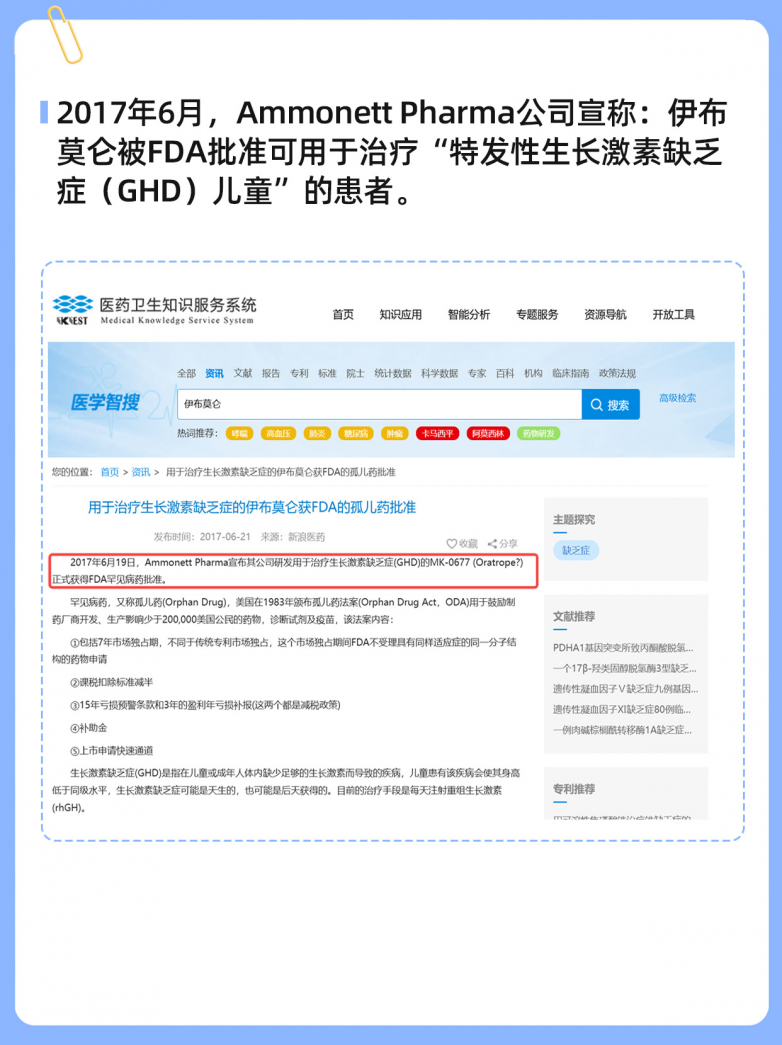
美国食品药品监督管理局(FDA)近日发布公告,提醒消费者警惕一款含有未明示成分伊布莫仑的膳食补充剂。这一警示让伊布莫仑再次进入公众视野。
与此同时,这种被世界反兴奋剂机构(WADA)列为禁用物质的化合物,却在医药研发领域展现出潜力,正被研究用于治疗儿童生长激素缺乏症。
01 监管警报与研发曙光
伊布莫仑,又称MK-677,是一种尚未获批正式上市的实验性化合物。它能激活生长激素促分泌素受体,刺激脑垂体释放生长激素,进而提升胰岛素样生长因子-1水平。
正是这一机制,赋予了伊布莫仑双重身份。
在健身和体育领域,伊布莫仑因可能促进肌肉增长、减少体脂而受到追捧,自2024年起被WADA列入禁用清单。
而在医学领域,伊布莫仑已获得美国和欧盟的孤儿药资格,针对儿科生长激素缺乏症的3期临床试验正在进行中。
02 作用机制与临床价值
伊布莫仑本质上是一种生长激素释放肽的拟态物,能够模仿人体内饥饿素的功能。
通过与脑垂体的生长激素释放激素受体结合,伊布莫仑促进生长激素分泌,从而参与调节生长发育、代谢及肌肉合成等生理过程。
研究表明,每日服用5-25毫克伊布莫仑可显著提高生长激素水平,这在生长激素缺乏症、肌肉萎缩、骨质疏松等疾病领域具有治疗潜力。
一项针对特发性生长激素缺乏症儿童的临床研究显示,短期服用伊布莫仑总体耐受性良好,无严重不良事件发生。
03 风险与剂量密切相关
伊布莫仑的安全性问题同样值得关注。FDA指出,它可能引发食欲增加、水肿、疲劳等副作用,甚至可能改变糖代谢和胰岛素敏感性。
值得注意的是,这些副作用主要与生长激素水平提升相关,而非伊布莫仑直接导致。
一项针对绝经后骨质疏松症女性的研究发现,伊布莫仑实验组出现了生长激素介导形成的液体潴留。
而另一项针对60岁及以上髋部骨折恢复者的研究,则因充血性心力衰竭的安全隐患而提前终止。
这些研究提示,伊布莫仑的风险与剂量密切相关,在老年及心功能不全人群中使用需格外谨慎。
科学探索的道路总是充满挑战与争议。对于伊布莫仑这类尚处于研发阶段的化合物,公众既不应因其“增肌”效果而盲目追捧,也不该因其被列为兴奋剂而全盘否定其潜在价值。
只有在严格监管和科学指导下,才能真正发掘其作为药物的潜力,同时最大限度控制风险。



